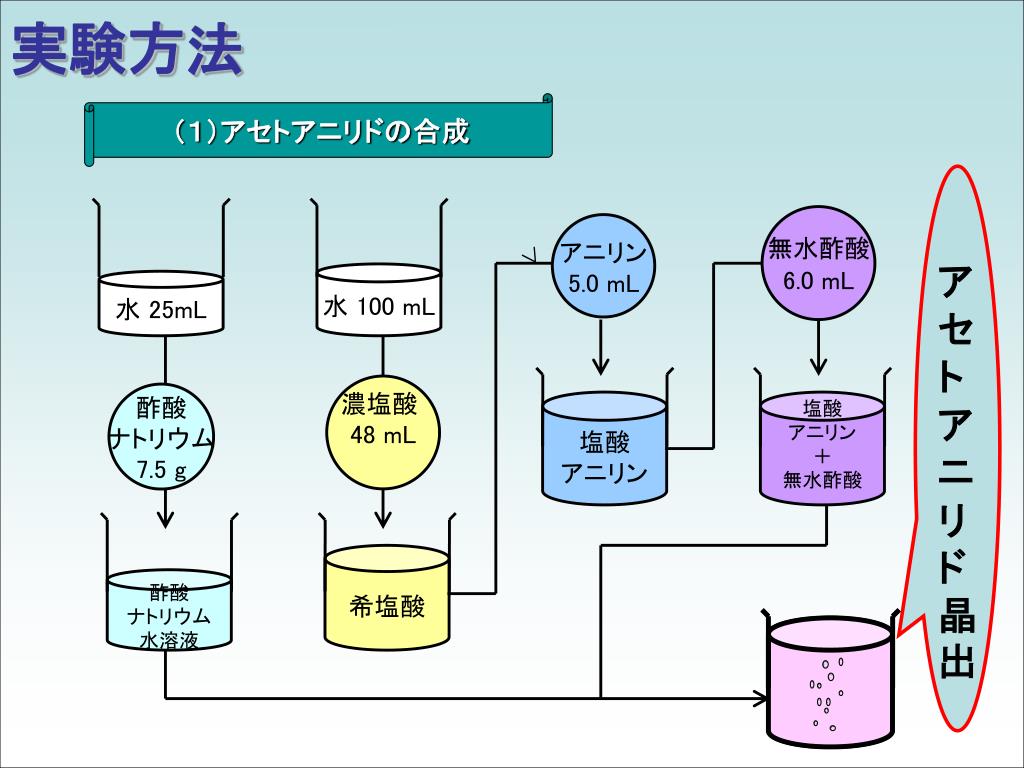
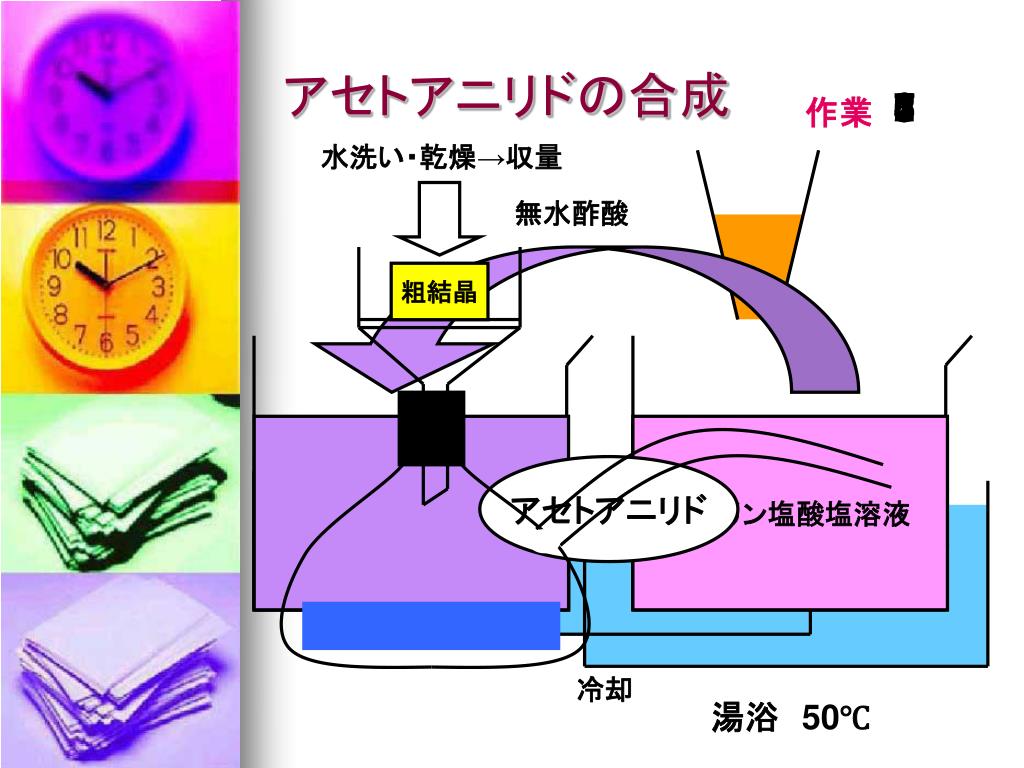
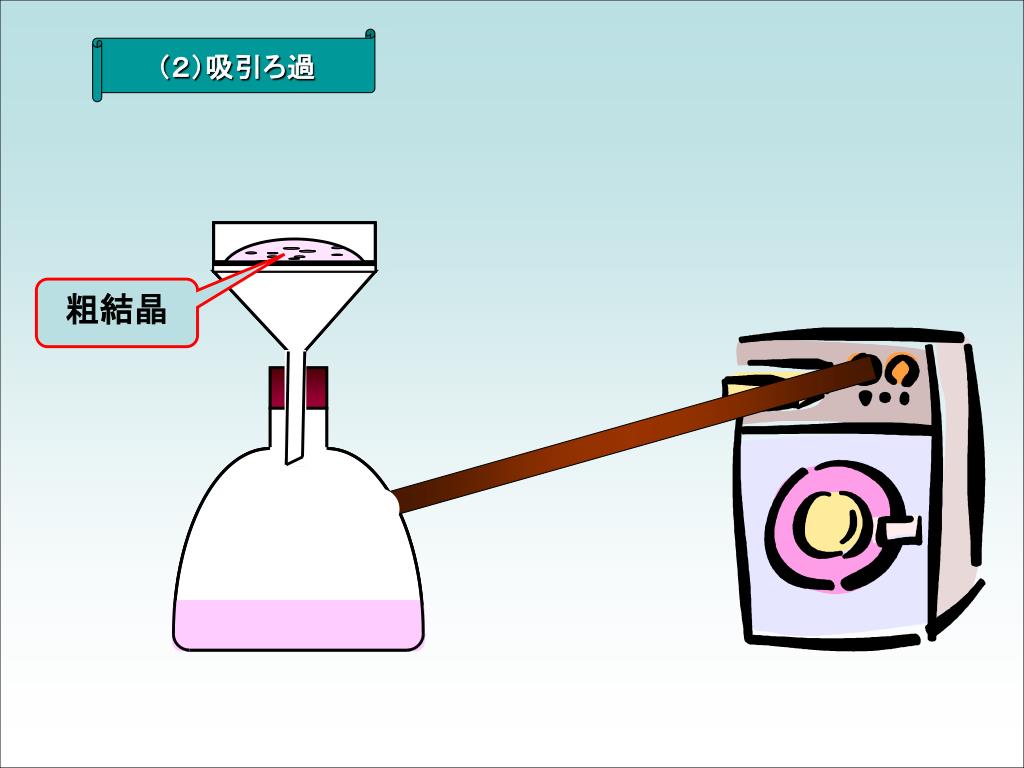
アニリンとアセトアニリドの違い との差 アニリンおよびアセトアニリドは窒素含有有機化合物である。 それらは非常に異なる化学的および物理的性質を持っています。 アニリンはさまざまな産業で多くの用途があります。 アニリンは、アミン基に結合C をビーカー(0mL)に入れた氷水で冷却したところ、結晶化した。 ブフナーロートを用いてC の内容物を吸引ろ過した。 ブフナーロート上の試料の湿り気を濾紙で吸い取った後、試料乾燥用の乾燥機内に15 分間放置し よく乾燥させた。(4) 生じたアセトアニリドの結晶を、ブフナーロートを用いた吸引ろ過で集め、少量の冷水で 洗う。 (5) 得られた粗結晶を三角フラスコ(0 mL)に入れ、水50 mL を加え、沸騰した水浴中で加 熱する。もし溶けきらないときは、水の量を増して溶かす。

サルファ剤合成 Step5 Last スルファニルアミドの合成 Synthesis Of Sulfanilamide Youtube
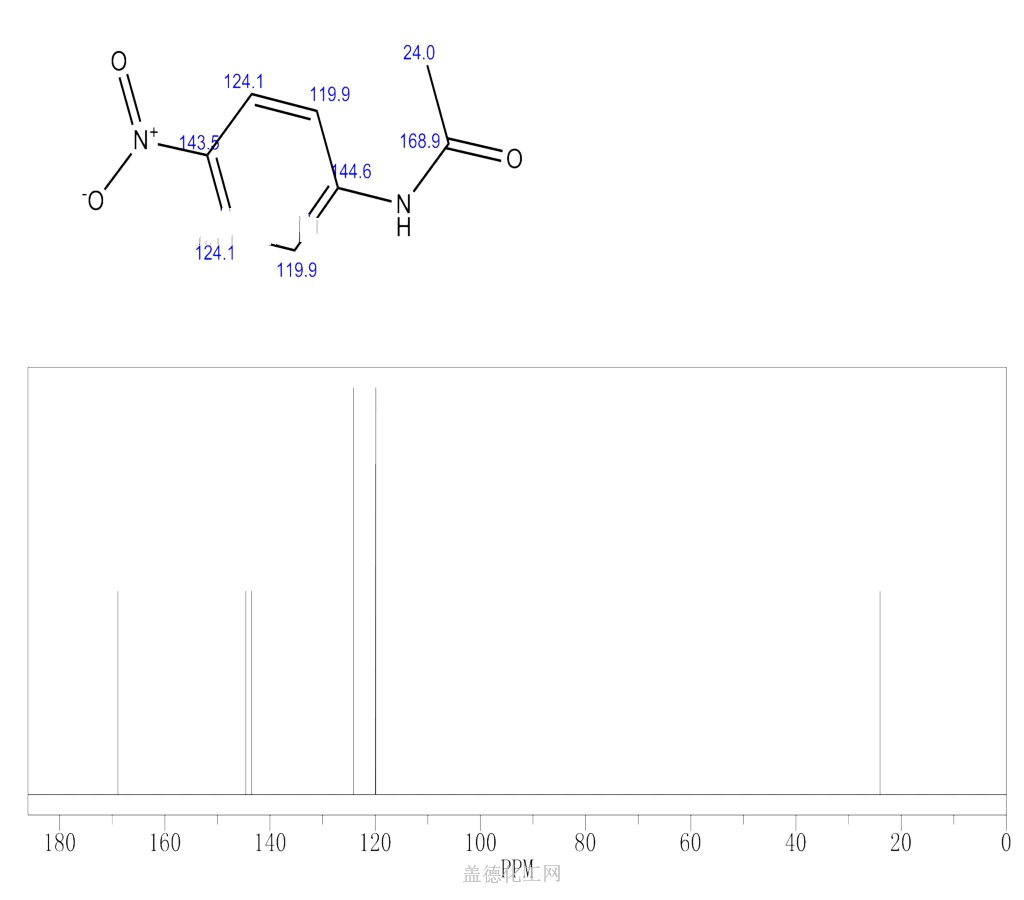
アセトアニリド 結晶 色
アセトアニリド 結晶 色-淡黄色液体 有害 潤滑剤 c 6 h 5 nh 2 アニリン 融点 -6℃ 沸点185℃ 染料や香料の原料 c 6 h 5 nh 3 cl アニリン塩酸塩 融点198℃ c 6 h 5 nhcoch 3 アセトアニリド 融点115℃ 沸点304℃ 無色板状結晶 初の合成解熱剤残りは再結晶を行い 精製する。精製後の結晶の質量を測定し、収率を計算する。 (ウ)物理分野 ①理学部 実施日時 平成16年8月10日(火(午後1時~5時)) 11日(水(午前9時~午後4時30分)) 酢酸エチルの合成 バイルシュタイン反応 アセトアニリドの合成



アシックスgt 2000 8 8 体育社店アシックスgt 2000
Feb 07, 21 · まず、 アセトアニリド の章では、アセトアニリドの基本的な物理量や物性,合成法,実験についての注意事項,理論収量や収率の算出方法,反応機構などについて紹介します。 次に、 再結晶 の章では、再結晶の基本的な原理や今回の実験との関連性について紹介します。 さらに、 TLC (薄層クロマトグラフィ―) の章では、TLCの基本的な原理,今回の実験での利用アセトアニリド,001, 5/7 11 有害性情報 毒性学的影響に関する情報 急性毒性 急性毒性(経口) 日本公表根拠データ (アセトアニリド) rat LD50=1959mg/kg (SIDS, 01) 局所効果 皮膚腐食性/刺激性データなし 眼に対する重篤な損傷性/眼刺激性 日本公表根拠データ白色~ほとんど白色粉末~結晶 純度(gc) 990 %以上 融点 1340 ~1380 °c
日本大百科全書(ニッポニカ) アセトアニリドの用語解説 酢酸とアニリンのアミド。アセチルアニリン、nフェニルアセトアミドともいう。アニリンに無水酢酸あるいは塩化アセチルを反応させて得られる。無色の板状結晶。冷水に約05%、熱水には約5%溶ける。Nov 18, · アセトアニリド ニトロ化 温度 15 ・電子吸引性はメタ配向性 "Lanthanide triflate and triflide catalyzed atom economic nitration of fluoroarenes" Synlett 0001 (00) 5758 (3)も同様です。 一般に、温度をあげるほど反応速度は上がります。Jun 08, 19 · 再結晶後などで着色している場合、溶媒をメタノールやエタノール、水などの極性溶媒に置換して、活性炭を化合物1gあたり100mgくらい加えます(入れすぎ注意!)。熱している場合は突沸することがあるのである程度冷ましてから入れます。
アセトアセトアニリド TCIA0046。視野最大幅 6mm。クロスニコル。 融液の温度を下げていくと、ある温度から結晶相の構造が変わります。片方は単斜。 単斜の相は、基盤に引きずられて少しずつ曲がりながら、平行連晶を作っていくのがよく見えます。本実験は、アニリンのアセチル化によるアセトアニリドの合成を行うこと、再結晶による精製を行うこと、粗結晶と精結晶の融点測定から合成物質の同定を行うことを目的としたものである。 緒言 有機合成とは アセチル化とは 再結晶とは 融点測定とは 実験 関連物質の物性 使用器具 実験1.はじめに 全学共通科目化学実験科目では学生アンケートを平成16 年度,18 年度, 年度に実施し,履修生の目から見た本科目の現状と問題点の把握を行ってきた



クラフトプラス 0系ハイエース 標準ボディ エスエイチカンパニー ステージ2 センターコンソールボックス 車用品 ブルックリンスタイルタイプ1 ステージ2



ブラッドリー Bradley Vera メンズバッグ ヴェラ Iconic バッグ レディース バッグ レディース Backpack Xl Campus Fermart バックパック リュック Makani Paisley Sh2 6606 フェルマート 2号店
Jul 10, 14 · ナスフラスコに水を加え、その後アニリンを加え、無水酢酸を加えるとピンク色の溶液と結晶ができました。 アセト アニリドは無色であるはずなので、文献を調べるとどうもアニリンが酸化され不純物を含み、それが結晶となって発色したのではないかということが分かりました。Nov 21, 04 · アセトアニリドの合成の実験を行ったのですが、塩酸にアニリンを入れ、そこに無水酢酸を入れて、そこに酢酸ナトリウムを入れると、普通なら白色の結晶ができるはずですが、なぜかピンク色になりました。アセトアニリド 作成日 13/2/15 1.化学品及び会社情報 化学品の名称 アセトアニリド (Acetanilide) 製品コード 24A6011 会社名 株式会社




数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc



応用編
May 07, 04 · 粗アセトアニリンを再結晶しアセトアニリンを生成したところ85%近くあった収率が38%まで極端に下がりましたなぜだかわかる方教えてください。要は、再結晶の目的にもよります。純粋な物質を取り出して正確な物性を計りたいのであれば、動画は 有機化学実験 において実習する,次の反応で生じる 4メトキシ2ニトロアセトアニリドを例にとって,「熱時ろ過と再結晶」を説明している. 微量の不純物を含む結晶性の試料を精製する方法である. 熱時ろ過によって,溶媒に溶けない不純物は,ろ紙上に取り除かれる. 再結晶によって,溶解度の大きな不純物は,溶液中に溶解したままとなる. 不純物白桃色の大きな結晶 精製合成物 115℃ 白色結晶の針状結晶 3)出発原料アニリンを基準として、未精製および精製アセトアニリドの化学収率をそれぞれ計算し実収量が理論収量に到達しなかった理由。 アニリンは11×10^2mol用いられている。 アニリン1molからアセトアニリド1molが生成されるので アニリンは11×10^2molからはアセトアニリド11×10^2molが生成さ




103 84 4 アセトアニリド Acetanilide 017 011 詳細情報 ライフサイエンス 試薬 富士フイルム和光純薬



Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id
今日の実験は、p-ニトロアニリンの合成でした。 ・手順 1) まず最初に、 前回の実験で生成したp-ニトロアセトアニリドを、 2 g程薬包紙経由でナスフラスコに量りとって、12 N(『12規定』の意味)の、 濃塩酸(ここは教科書と違う)を ml程度加える。Cas番号:,国連番号:,示性式:CH3CO・NH・C6H4・NH2,状態:固体,色:無色または淡紅色の結晶。,臭気:,物質名称:p-アミノアセトアニリド、 p-Aminoacetanilide、 1-アセチルアミノ-4-アミノベンゼン、 N-Acetyl-p-phenylenediamine、 N-(4-Aminophenyl)acetamide、 4'-Aminoacetanilide、 1-AcetylaminoOct 30, 08 · 明日から火曜まで大学祭関係でお休み。5連休なり。さておき、今日の実験ではアニリンからアセトアニリドを合成した。アセトアニリドはアニリンに無水酢酸を反応さることで合成できて、アニリンのnh2がnhcoch3になったものである。まずアニリン水溶液に塩酸を加え、続いて無水酢酸、酢酸



粗結晶 に関するq A Yahoo 知恵袋




サリチル酸メチル アセチルサリチル酸やアセトアニリドなどの語呂合わせ 18東工大 第12問よりその2 入試化学を語呂合わせで解く大学入試ゴロ化学
Biodegradation of butachlor by Rhodococcus sp strain B1 and purification of its hydrolase (ChlH) responsible for Ndealkylation of chloroacetamide herbicides PMID ;アセトアセトアニリドは,iupac命 名法に準拠する と,3オキソnフ ェニルーブタンアミドと呼ばれ,現在, わが国では,年 間約600ト ン(平成元年度推定)が生産さ れ,主 として,黄 色系染顔料の製造に使用されている。 1 製 法Apr 27, 09 · アニリンに無水酢酸をガラス棒でかき混ぜつつ加え、冷却して得たアセトアニリドが淡黄色の粗結晶として得られました。




アセトアニリド Wikipedia




化学実験 パラニトロアニリン赤の合成と染色 慶應義塾大学日吉キャンパス 特色gp 文系学生への実験を重視した自然科学教育
図4 アニリンの呈色反応と染料 (iii) アシル化合物との反応 アニリンに酢酸 CH 3 COOH と濃硫酸 H 2 SO 4 を加えて加熱するか、または無水酢酸 (CH 3 CO) 2 O を作用させてアセチル化すると、アミドの一種である「アセトアニリド」が生成します。 アセトアニリドは、無色無臭の板状結晶 (mp115 ℃)人工的に作られた最初の合成解熱剤がアセトアニリドであり,以前はアンチフェブリン(Antifebrin)の名称で呼ばれた.1853年に仏の化学者 Gerhardt(ジェラール)により合成され,その解熱効果が 16 年に報告された.ただし,服用すると血球の破壊など中毒作用が強いため,現在ではあまり使われていない.無色板状結晶で,融点は 113~114℃.結晶の形状,色などを観察せよ。 (純度を調べる) ⑥ 精製した結晶を少量試験管にとり,そこへ少量のさらし粉溶液を入れてみよ。未反応 のアニリンが含まれていれば 紫 色 になる。 2.パラニトロアセトアニリドの合成 (ニトロ化)



アセトアニリド 合成




アセトアニリド 合成
(7) 沈殿物を少量の水で再結晶する。 (8) (7)で出てきた結晶をろ過する。 (9) 反応が進んだことを薄層クロマトグラフィー(以下TLC)で確認する。 2 p-ニトロフェノールの還元 (1) p-ニトロフェノールを三角フラスコに1g 取り、粒状のスズを2g、濃塩酸を54メチル2ニトロアセトアニリド (MNA)のこはく色多形の結晶および分子構造 Crystal and molecular structure of an amber polymorph of 4methyl2nitroacetanilide (MNA) 文献の概要を数百字程度の日本語でまとめたものです。 部分表示の続きは、JDreamⅢ (有料)でご覧頂けます。 JGLOBALでは書誌 (タイトル、著者名等)登載から半年以上経過後に表示されますが、医療系文献の色 白色 性状 結晶~結晶性粉末 臭い データなし 融点/凝固点 114 117 °c 沸点又は初留点及び沸騰範囲 304 °c 可燃性 データなし 蒸発速度 データなし 燃焼性 (固体、ガス) データなし _____ ページ 3 / 6 w01w jghejp アセトアニリド



ドールハウス型収納棚 ドールハウスシェルフ 収納 代引き 同梱不可 あっとらいふごっこ遊びが楽しめます 収納用品 Hsj 60m




サリチル酸メチル アセチルサリチル酸やアセトアニリドなどの語呂合わせ 18東工大 第12問よりその2 入試化学を語呂合わせで解く大学入試ゴロ化学
23 個の粒子の集団ですから(アボガドロ数),例えばアセトアニリド1mgはC 8 H 9 NO=から計算して, 6×10 23 ×(1×103 /) =6×10 / =44×10 18 と言う数(44兆の百万倍)の分子になります.耳掻き一杯にも満たない物質量ですが,驚くべき数の集団です.これに比べると地球上の人口の50億鉱物の光沢の種類 ・金属光沢 / 金属のような光沢(例:金,黄鉄鉱,黄銅鉱,方鉛鉱,硫ヒ鉄鉱など) 単体金属の元素鉱物,12 族(亜鉛など)以外の金属元素・半金属元素(テルル・ヒ素・アンチモン・ビスマス),イオウ,セレンからなる鉱物(硫化鉱物,セレン化鉱物,テルル化鉱 物Nov 27, 06 · アセトアニリドの合成の実験を行ったのですが、塩酸にアニリンを入れ、そこに無水酢酸を入れて、そこに酢酸ナトリウムを入れると、普通なら白色の結晶ができるはずですが、なぜかピンク色になりました。 その原因について、 (1)何か副生成物ができた




Gucci 長財布 エナメル Khk Phi Rs



Ppt アセトアニリド Powerpoint Presentation Free Download Id
この 結晶 を2回水 で再結晶 して 精製 した 。融点 は172℃であった 。メルクインデックス の融点 169-1705℃より 少し高いが ,融点 169-172℃という 文献 もある 。 塩化鉄 (Ⅲ)反応 を調べると ,呈色 した 。ただし ,この 結晶 は冷水 に溶けにくいため ,物理的状態、形状、色など: 黄色の結晶又は粉末 14) 臭い: データなし pH: データなし 融点・凝固点: 148℃(融点) 14) 沸点、初留点及び沸騰範囲: 332℃(沸点) 14) 引火点: 332℃ 14) 爆発範囲: データなし 蒸気圧: 02Pa (℃) 14) 蒸気密度(空気 = 1): 48 14)従来の技術Industrial Oraganic Chemistry, Second, Completely Revised Ed,Willy Herbst, Klaus Hunger, (1997), VCH, A Wiley companyには、1)346〜347ページに、式(II)の一般式で表されるアセトアニリドベンツイミダゾロン系アゾ顔料は、耐溶剤性・耐光性に優れた顔料であり、その色




Gem Stone King 1 67カラット 天然 スモーキークォーツ ブラウン 天然 ダイヤモンド 14金 イエローゴールド K14




号 非晶性ポリエステル樹脂エマルションを製造するための溶媒を含まない転相乳化プロセス Astamuse
進行し,灰 色になったTi3は 再び酸化されて白色の TiO2に もどる。光エネルギーの照射が連続的に続くと, 酸化チタン粒子表面の酸素欠陥は,内 部の結晶構造中の 酸素を取って欠陥をうめようとする。この様な形で, 還色 うすい黄色 褐色 性状 結晶~結晶性粉末 臭い データなし 融点/凝固点 93 °c 沸点又は初留点及び沸騰範囲 データなし 可燃性 データなし 蒸発速度 データなし 燃焼性 (固体、ガス) データなし 爆発下限界及び爆発上限界/可燃限 界 上限: データなし60 (50) Name matches chloroacetamide 2chloron (2,6dimethylphenyl)acetamide




サルファ剤合成 Step5 Last スルファニルアミドの合成 Synthesis Of Sulfanilamide Youtube




アセトアニリドの合成 アセトアニリド 再結晶 Tlc 薄層クロマトグラフィー 融点測定 Transblog
4ニトロアニリン、または pニトロアニリン(パラニトロアニリン) は、有機化合物のひとつで、ベンゼンのパラ位の水素がアミノ基とニトロ基が置き換わった構造を持つ。 色素や医薬品合成の中間体、酸化防止剤、ガソリンのガム状化防止剤、家禽の医薬品、腐食防止剤としての用途がある。Journal of agricultural and food chemistry 12 Dec;4ニトロアニリン,, 1/8 作成日: 15年07月27日 改訂日: 21年03月03日 安全データシート 1 化学品及び会社情報




アセトアニリド 合成 今度実習でアニリンと無水酢酸でアセトアニリドを合成します 理論



Ppt アセトアニリド Powerpoint Presentation Free Download Id
Sep 30, 11 · アニリンは本来,無色の液体であるが,空気に触れると淡赤色を呈する。アニリンを酸化す ることによって黒い染料が得られることは, 4年にドイツの化学者FF Rungeによって見 出さ




アニリン 無水酢酸 赤色 アニリン 無水酢酸 赤色



応用編



アセトアニリド 合成 アセトアニリドの合成実験




Ppt アセトアニリド Powerpoint Presentation Free Download Id




フェノール類とアニリンの呈色反応の語呂合わせ 18h30大学入学共通テスト試行調査第2回第3問b 入試化学を語呂合わせで解く大学入試ゴロ化学



50 43 3 2 4 ジメチルアセトアニリド 2 4 Dimethylacetanilide 326 051 324 052 詳細情報 試薬 富士フイルム和光純薬




高校化学 アニリンと無水酢酸の反応 映像授業のtry It トライイット




共通テスト化学 平成30年プレテスト第3問 大学受験in北海道




マーク フィッシャー Marc Fisher Ltd レディース サンダル ミュール シューズ 靴mango Suede Phi Rs



アセトアニリド 合成 アセトアニリドの合成実験




Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id




Woa1 積層体 成形体及び当該成形体の製造方法 Google Patents




Woa1 積層体 成形体及び当該成形体の製造方法 Google Patents



アシックスgt 2000 8 8 体育社店アシックスgt 2000



最も検索された ニトロアセトアニリド 溶解度 人気の画像をダウンロードする




1994 号 磁性流体及びその製造法 Astamuse



ベンチプレス トレーニングベンチ ベンチプレス エバニュー 店 Etb324 Evernew スポーツ Ev Etb324 Sportsman Jp Etb324 プリチャーカールベンチ




Woa1 積層体 成形体及び当該成形体の製造方法 Google Patents




芳香族アミン アニリン の構造 製法 性質 反応 化学のグルメ




Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id




フェノール類とアニリンの呈色反応の語呂合わせ 18h30大学入学共通テスト試行調査第2回第3問b 入試化学を語呂合わせで解く大学入試ゴロ化学




アセトアニリドの合成 アセトアニリド 再結晶 Tlc 薄層クロマトグラフィー 融点測定 Transblog



空気清浄器 Breathesmart ペットのいるお部屋用 Fit50 Purifier 家電 Smartsensor アレルギー予防 除湿機 Air And Cover With Smartsensor Alen Oak And Whispermax Technology Au B01myrlzrk あべじゅん




Woa1 へテロ環アゾ系色素を含むインク及び該インクに用いられる色素 Google Patents



ベンゼン Benzennne Twitter



Ssh関連カテゴリー 体験型実習講座 山形県立 東桜学館 中学校 高等学校




Ppt アセトアニリド Powerpoint Presentation Free Download Id




第10課 芳香族化合物 2 Xmind Mind Mapping Software




アセトアニリドの合成 アセトアニリド 再結晶 Tlc 薄層クロマトグラフィー 融点測定 Transblog



Ppt B 08 5025 柳本 三厳 L 5026 新里 康秦 P 5028 杉原 澄洋 D 5023 金子 恵 A Powerpoint Presentation Id




Jpb2 不定形耐火物 Google Patents




化学実験 パラニトロアニリン赤の合成と染色 慶應義塾大学日吉キャンパス 特色gp 文系学生への実験を重視した自然科学教育




炎色反応 炎色反応 スペクトル線 Transblog




1994 号 二色性染料改良剤 Astamuse



有機染料または染料製造に密接な関連を有する化合物 媒染剤 レーキ C09b 1951件




サリチル酸メチルの合成 エステル化 サリチル酸 サリチル酸メチル Transblog




Ppt アセトアニリド Powerpoint Presentation Free Download Id



今日の実験 アセトアニリドの合成 196 の部屋




アニリン 合成 化学反応式 アニリン塩酸塩 有機化学 高校化学 エンジョイケミストリー Youtube



No comments:
Post a Comment